Immersion au cœur de l’usine du futur

Digitalisation, Data Science, etc., la transformation du monde industriel est en marche avec de réels impacts sur la chaîne de valeur des biomédicaments de plus en plus intégrée et connectée. À la clé, des gains en fiabilité, productivité et accessibilité pour les patients. Avec, dans le cas de l’Evolutive Vaccine Facility de Sanofi (EVF), l’ambition de renforcer l’autonomie sanitaire et de se préparer aux futures pandémies.
En 2030, on estime que 50% des médicaments prescrits seront des biomédicaments. Des molécules thérapeutiques de grande taille, produites à partir de cellules vivantes (bactéries ou cellules de mammifères) par rapport aux synthèses chimiques. « Le rythme d’innovation s’accélère fortement avec une offre qui se diversifie et se complexifie », note René Labatut, responsable de la stratégie d’innovation technologique pour les produits biologiques chez Sanofi. Chaque cas est particulier dans le sens d’une médecine finement adaptée aux besoins du patient, voire personnalisée. « Nous avons aujourd’hui les protéines recombinantes spécifiques, multispécifiques, des nanobodies, enzymes, antigènes au niveau des vaccins, acides nucléiques (ADN, ARN, etc.), mais aussi les thérapies géniques (in vitro/in vivo) et cellulaires dont une spécificité est d’intégrer le patient à la liste des matières premières. » Avec le potentiel de traiter et de guérir de nombreuses maladies incurables, comme le cancer, par exemple, dans le cas des cellules CAR-T.
Une urgence sanitaire et économique
« La problématique est de maîtriser cette diversité de bioprocédés, avec agilité et efficacité, pour rendre ces biothérapies accessibles et disponibles rapidement pour les patients », continue-t-il. Avec un enjeu de filière pour la bioproduction française, révélé dans la crise de la Covid, et la nécessité de reconquérir une place dans la compétition mondiale. En 2017, sur 97 biomédicaments autorisés en Europe, six seulement étaient produits ou prévus de l’être en France. Et moins de 10 % des anticorps monoclonaux actuellement utilisés dans le système de santé sont fabriqués sur le territoire. « Si nous ne sommes pas capables d’en produire une grande partie, nous serons soumis aux aléas des marchés mondiaux, avec des risques majorés en termes d’accès à ces produits, de soutenabilité financière et de disponibilité des stocks », note Jacques Volckmann, vice-président de la R&D de Sanofi en France, qui vient de prendre la tête de l’Alliance France Bioproduction, avec Emmanuel Dequier, qui dirige le Grand Défi Biomédicaments. Pour la filière, ce qui compte est d’aligner les acteurs et de multiplier les chances de réussite.
Vers des usines compactes et flexibles
C’est là qu’intervient l’usine 4.0 voire 5.0 qui permet une approche globale, du développement à la production de ces biomédicaments, sur toute la chaîne de valeur. En s’appuyant sur les nouvelles technologies, l’idée est de connecter le besoin du patient final à la production. « La voie de la personnalisation », selon René Labatut. Avec le souci également de sécuriser la maîtrise des processus de production grâce à des capteurs et du contrôle en ligne, couplé à de l’intelligence artificielle. Ce qui permet de faire de l’intensification et de l’analyse prédictive, mais aussi du contrôle prescriptif de procédés. « À l’aide de la Data Science, qui transforme les données en informations, on peut augmenter le niveau de connaissance et générer des pistes d’amélioration continue de manière significative », note-t-il. L’objectif du CSF-ITS* est ainsi d’augmenter les rendements d’un facteur 10 à 1000 en l’espace de dix ans. Au final, ces progrès conduisent à des unités de production compactes et flexibles, fonctionnant en circuits fermés, avec de l’usage unique, et une capacité à se reconfigurer rapidement grâce à la donnée pour faire face aux besoins. Et cela, dans le respect des conditions BPF : traçabilité, intégrité des données, sécurité. Un exemple est l’usine totalement connectée de Sanofi à Framingham, vers Boston, aux États-Unis, qui produit des protéines recombinantes et des cellules de mammifères sur une ligne polyvalente. Le cran d’après est l’Evolutive Vaccine Facility (EVF), en construction à Neuville-sur-Saône, près de Lyon, dont l’avantage est d’être multiplateforme pour fabriquer des protéines recombinantes, des vecteurs viraux et de la bactériologie.
(*) CFS-ITS : Comité stratégique de filière pour les industries de technologie et de santé.
« Maîtriser cette diversité de bioprocédés avec agilité et efficacité »

« Le rythme d’innovation s’accélère fortement pour les biomédicaments »
René Labatut, responsable de la stratégie d’innovation technologique pour les produits
biologiques chez Sanofi.
Comment l’usine 4.0 va transformer les métiers ?
La gestion prospective des emplois, voilà l’un des grands enjeux de l’usine du futur ! Plus d’une douzaine de parcours de formation ont déjà été identifiés par le Campus Biotech Digital, à l’initiative de Sanofi, bioMérieux, Servier et Novasep. Parmi lesquels l’Environnement de production (des biomédicaments et de l’usine), la Data Integrity (adaptée en particulier au contrôle qualité), le principe actif (Drug Substance) jusqu’au biomédicament (Drug Product), en incluant les Fonctions Supports, le Contrôle Qualité, la gestion de la chaîne du froid, les systèmes de délivrance, etc., jusqu’aux nouveaux métiers émergents de Data Analysts (analyste de données), Bioprocess Designers (développeurs) et Bioprocess Analytic (spécialiste de l’analytique des données). Une bonne dose de modernité technologique pour attirer les jeunes générations !

JEAN-CHARLES ROUSSET, Directeur du site d’Aspen Pharma à Notre-Dame-de-Bondeville, en Normandie
« Accompagner les générations pour éviter la perte de sens »
« Dans l’industrie, la plupart des Big Pharma et des PME ont lancé leur chantier usine 4.0 (ou 5.0). Avec au départ, souvent, la nomination d’un Chief Digital Officer pour engager la digitalisation. Chez Aspen Pharma, on élabore notre feuille de route numérique, en se concentrant sur l’environnement informatique qui nous permettra de répondre aux défis d’avenir. C’est une véritable transformation en plusieurs étapes pour mieux maîtriser nos procédés. L’information est collectée sur nos automates industriels, puis stockée dans un lac de données (Data Lake), pour réaliser des analyses avancées (Advanced Analytics) sur nos lignes. Parmi les outils de pilotage, nos équipes s’appuient sur des tableaux de bord et cockpits virtuels pour conduire le changement en temps réel, avec la dématérialisation de nos points journaliers pour accélérer la prise de décision. La modélisation à partir d’algorithmes permet d’optimiser la planification des lignes, mais aussi les contrôles qualité. Un autre axe, dans le cadre du Consortium Polepharma Blockchain (lire p.22), est d’aller vers la Data Integrity pour sécuriser nos informations. Ce que revêt l’usine 4.0 est une mutation profonde de notre manière de travailler. Il faut un temps pour s’approprier le vocabulaire et les nouveaux outils, s’adapter aux nouvelles exigences, mais aussi accompagner les compétences et les générations pour éviter la perte de sens dans l’entreprise. »

AFIF MEDJAHED, Directeur pédagogique du Groupe IMT
« Trois axes pour apprendre à travailler autrement »
« Le Groupe IMT travaille avec de nombreux laboratoires pour former des opérateurs et des techniciens (production, maintenance et services support) qui soient capables d’évoluer au sein d’usines 4.0, dites intelligentes, dans lesquelles l’automatisation, la robotisation et la digitalisation sont de plus en plus intégrées pour accroître la performance globale. Sur l’axe de la donnée, les apprenants devront savoir analyser les données fournies par les procédés et les équipements dans une logique de résolution de problèmes et d’amélioration continue. Mais aussi, pour les techniciens de maintenance, les décliner en plan de suivi pour assurer la fiabilité des équipements. La tendance est d’aller vers de la maintenance prédictive pour prévenir les pannes. Sur les nouvelles technologies, le Groupe IMT s’est équipé de trois robots collaboratifs, dont l’un est intégré à notre ligne de conditionnement à l’UTD de Tours, pour former à la prise en mains et au paramétrage. Dans les cas pratiques, les promotions (TPCI, TSPCI, TSBI) travaillent déjà sur l’amélioration continue et les futurs ingénieurs (5ème année avec l’ESITech) sur le transfert d’un procédé de fabrication biotech à partir du jumeau numérique du Bio3 Institute. Lancé sur une promotion TPCI 4.0 pilote, le programme 4.0 sera décliné sur tous les cursus. En parallèle, le Groupe IMT a “designé” trois salles collaboratives avec écrans et tablettes connectées pour travailler en mode projet. In fine, l’objectif est d’avoir un opérateur ou technicien “multicarte” qui maîtrise la digitalisation et les technologies connectées sur les équipements, mais présente également une bonne culture pharmaceutique et des compétences transverses (analyse de données, capacité à travailler dans un environnement 4.0) pour participer à l’optimisation des procédés. »
Un environnement tactile et numérique est propice à l’interaction en petits groupes avec le formateur accompagnateur.

RÉGIS GERVIER, Directeur du projet EVF chez Sanofi Pasteur
« Une unité innovante dans son design et ses procédés de fabrication. »
Comment faire la genèse de l’Evolutive Vaccine Facility (EVF) ?
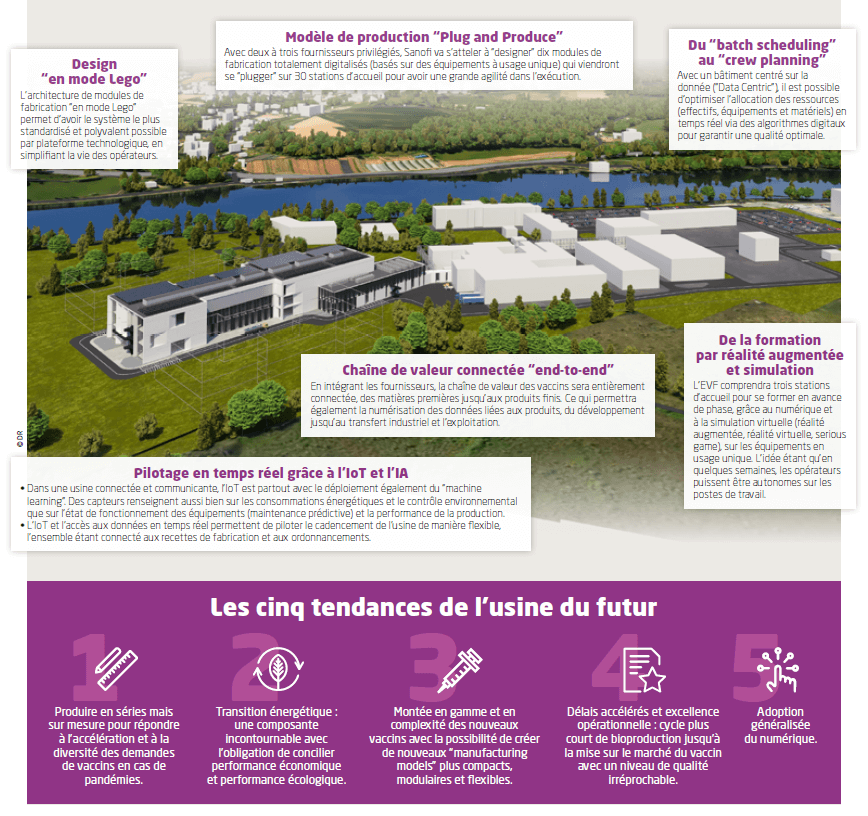
Ce projet d’usine évolutive est à la conjonction de plusieurs évolutions. D’abord, un portefeuille de vaccins qui s’élargit, avec des molécules de nature très différente et qui intègrent plus de complexité, de nouvelles opportunités à exploiter au niveau des équipements à usage unique, et l’arrivée de nouvelles technologies de bioproduction performantes, qui permettent d’envisager des unités plus compactes, avec une empreinte plus faible, modulables et plus flexibles grâce au numérique.
Où se situe l’innovation ?
L’innovation se situe à trois niveaux. D’abord, dans le design ultramoderne du bâtiment, qui comprend une unité centrale sur laquelle viennent se connecter des modules de production totalement digitalisés. À cela s’ajoute la standardisation des stations d’accueil (plusieurs dizaines par module) autour desquelles s’organise un système flexible de fabrication “Plug and Produce”. Enfin, nous travaillons sur la standardisation des unités opérationnelles basées sur des équipements à usage unique, permettant de couvrir cinq plateformes technologiques de production. C’est l’ensemble de ces innovations qui permettra de passer d’une série à une autre rapidement.
« Apporter au plus près de l’opérateur toutes les informations nécessaires pour faciliter la prise de décision en temps réel. C’est le concept de l’opérateur augmenté. »
En quoi cette unité est-elle “évolutive” ?
L’EVF est une unité centrée sur la donnée. Grâce à l’Internet des objets (IoT) et l’intelligence artificielle (IA), les capteurs postés au niveau du bâtiment et des équipements permettront la remontée d’informations pour faire du contrôle avancé de procédés ou de l’ordonnancement de production. Les capacités de production du bâtiment sont également “évolutives”. Nous prévoyons un premier module capable de produire trois à quatre vaccins par an pour répondre à la demande mondiale et de pouvoir tripler sa capacité. Ce qui est possible grâce à ses modules standardisés, facilement “duplicables”. Et en un temps record : nous estimons pouvoir étendre les capacités en deux ans et demi, contre quatre à cinq ans en moyenne dans la pharmacie.
Comment sont intégrés les fournisseurs ?
Nous souhaitons avoir une connexion très en amont avec nos fournisseurs pour garantir l’efficacité de l’unité. L’important est d’avoir une chaîne de valeur end-to-end connectée à toutes les données du fournisseur pour minimiser les interfaces, avoir accès aux paramètres critiques de nos procédés et optimiser notre “supply chain”.
Comment envisagez-vous la montée en puissance ?
L’EVF représente un investissement de 490 millions d’euros sur cinq ans, avec la création de 200 nouveaux emplois. Nous devrions choisir prochainement deux ou trois fournisseurs privilégiés pour nous aider à personnaliser et standardiser nos modules de fabrication. En parallèle, nous travaillons avec nos collaborateurs à mieux appréhender l’interface “homme/machine” et les nouvelles organisations de cette unité du futur. L’idée étant d’apporter au plus près de l’opérateur toutes les informations nécessaires pour faciliter la prise de décision en temps réel. C’est le concept de “l’opérateur augmenté”. En outre, l’EVF va accélérer la prise de poste en permettant de se former sur place, sous format virtuel.
Où en êtes-vous aujourd’hui de ces développements ?
Sanofi a annoncé l’EVF en juin 2020. Le premier coup de pioche est prévu à Neuville-sur-Saône au plus tard en novembre 2021. Dans notre calendrier, la qualification du bâtiment et de ses utilités devrait se faire mi-2023. Nous serons prêts à produire de manière commerciale dès fin 2025. Nous serons alors capables de répondre à 80 voire 90% de tous les systèmes de production existants de vaccins, dans des délais plus rapides, en fonction des enjeux de santé publique. C’est toute la beauté de ce système flexible et agile !
L’EVOLUTIVE VACCINE FACILITY (EVF)
La première usine entièrement connectée et modulaire pour les vaccins
Prévue pour s’étendre sur 15 000 m2 et trois niveaux à Neuville-sur-Saône (Rhône-Alpes), l’EVF est une nouvelle manière de concevoir les moyens de production pour de nouvelles générations de vaccins à l’ère de l’IoT, de l’IA et du Big Data.
Dossier réalisé par Marion Baschet Vernet.
Extrait du magazine Passerelles 77, pour consulter le magazine complet, veuillez cliquer ici.

